
近日,suncitygroup太阳新城尹敏课题组联合中国科学院昆明植物研究所黄胜雄研究员课题组,在催化领域知名期刊ACS Catalysis上发表了题为“Uncovering the Parallel Biosynthetic Pathways of the Cyclohexanone and Phenol Rings in Cycloheximide and Actiphenol by Tailoring Redox Enzymes”的研究论文。该研究揭示了苯酚和环己酮在相同生物合成机制下形成的一种罕见且不同的级联氧化还原机制,涉及到由羧酸还原酶和CYP450协同催化PKS产物引发的分子内羟醛缩合反应。这一发现扩展了对天然药物分子生物合成中氧化还原酶介导的酚和环己酮基团形成的理解,并为未来的组合生物合成新药研发奠定了基础。近年来,尹敏研究团队以云南本地多种中草药为研究对象,构建了药用植物内生放线菌库,通过多组学联合运用高效发现了系列高潜力菌株,获得了多个活性新天然产物,进而开展了生物合成机制的研究。
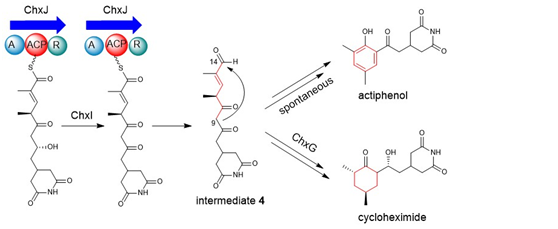
真核细胞翻译抑制剂放线菌酮(cycloheximide, CHX)及其类似物放线菌酚(actiphenol, APN)都具有特殊的戊二酰亚胺结构和六元碳环侧链基团。APN与CHX的区别在于其含有芳香酚环而非环己酮基团。在前期的天然产物发现工作中,作者注意到多株产生CHX的菌株能够同时发现有APN的产生(Highet et al. Helv Chim Acta, 1959;Rao et al. J Org Chem, 1960;Huang et al. J Antibiot, 2011;Liu et al. Front Microbiol,2022)。基于这一现象,作者团队推测CHX和APN可能通过同一生物合成途径进行合成(Yin et al. Org Lett, 2014),并提出了后修饰苯环脱芳可能是形成这两种化合物的关键机制。然而,这一假设主要得到了chxG或chxH基因敲除实验的支持,而缺乏相应的体外实验证据(图1B)。此外,由于常温常压下苯环难以实现脱芳化,六元碳环的形成机制仍存在不确定性。为了更深入地理解CHX和APN中两个不同基团的生物合成机制,作者选择了菌种库中能同时大量产生这两种化合物的药用植物内生放线菌Streptomyces sp. YINM00100作为研究对象,对其生物合成基因簇进行了详细分析(图1A)。研究发现,四种后修饰酶:烯酰还原酶(ChxG)、酮还原酶(ChxH)、细胞色素P450 (ChxI)和三结构域羧酸还原酶(ChxJ)可能参与新生聚酮中间体3的后修饰(图1B)。
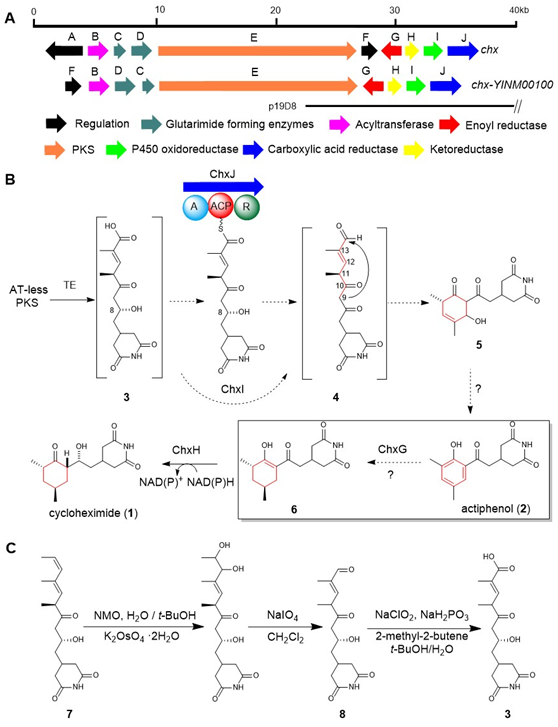
图1:(A) chx和chx- YINM00100 BGC的基因簇比较。(B)前期研究提出的CHX和APN的生物合成途径。(C)由化合物7化学合成化合物3和8。
在先前的研究中,作者通过体内敲除chxE、chxJ、chxI、chxG和chxH基因来探究它们在生物合成途径中的作用。除了ChxH外,其他三种酶的体外功能尚未确定。在本研究中,作者构建了chxJ、chxI和chxG基因敲除突变株,证明了chxJ和chxI在CHX和APN的生物合成中都起着重要作用,此外,菌株YINM00100的基因组中可能存在一个类似的基因可以补偿chxG的功能(图2A)。通过大规模发酵菌株Streptomyces himastatinicus ATCC 53653获得了足量的9-methylstreptimidone(化合物7),并通过化学合成得到了化合物3(图1C)。接下来通过酶学实验证明ChxJ能够以3为底物,以ATP和NADPH为辅助因子生成化合物8。用氧化剂DMP处理了中间体8,大部分底物转化为APN,但没有转化为中间体5,这表明8中的C-8羟基氧化导致自发环化,然后芳构化生成APN(图2B)。综上得出,ChxJ的A结构域激活并加载3到ACP上,接着ChxI将3-S-ACP中的C-8羟基氧化,最后由ChxJ的R结构域还原硫酯键获得化合物4,最后通过自发地分子内羟醛缩合和脱水芳构化形成APN(图2C和1B)。
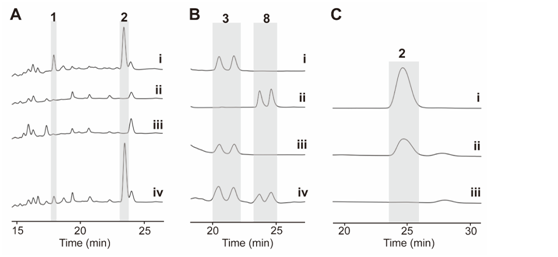
图2:(A)野生型和突变株的HPLC图谱。 (B) (iv) ChxJ与3孵育。 (C) ChxJ和ChxI与3孵育。
ChxJ和ChxI的组合足以产生APN,而ChxH和ChxG对于CHX的生物合成至关重要,这与作者早期的体内敲除实验结果一致。ChxH负责CHX生物合成途径的最后一步已经在先前报道的文章中证实,接下来重点研究ChxG。实验结果显示,化合物8能被ChxG还原为化合物9(图3A),这表明ChxG在CHX生物合成中的作用是介导不稳定的醛化合物4的C12-C13双键还原,生成新的中间体10,该中间体随后可自发进行醛醇缩合脱水生成11(图3B、图4)。随后将ChxJ、ChxI和ChxG组合在一起,以3为底物进行了一锅反应,证明了化合物4是ChxG的真实底物(图3C)。而化合物11可以在非酶催化条件下转化为化合物6(图3D)。此外,找到了一个ChxG的同源蛋白,并通过体外实验验证了其具有ChxG相同的活性。验证了ChxG在底物还原过程中的立体选择性与天然放线菌酮生物合成过程中C12和C13双键还原时的立体选择性是一致的(图5A)。最后,通过分子模拟对接分析以及后续点突变蛋白的构建,证明了氨基酸H162、H165和Y167对ChxG的还原活性起着至关重要的作用(图5B)。
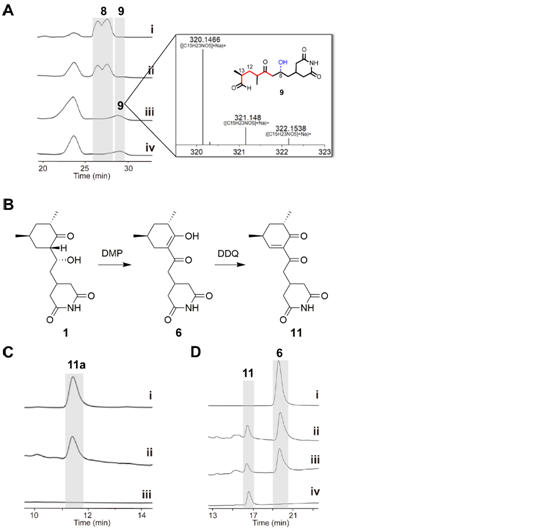
图3:ChxG的体外酶促反应。(A)ChxG化合物8生成9。 (B)由化合物1(CHX)化学合成化合物11和6。(C) ChxI、ChxJ和ChxG与3孵育,11易于发生酮烯醇互变异构生成11a。(D) NADPH在添加或不添加ChxG的情况下分别与11共孵育。
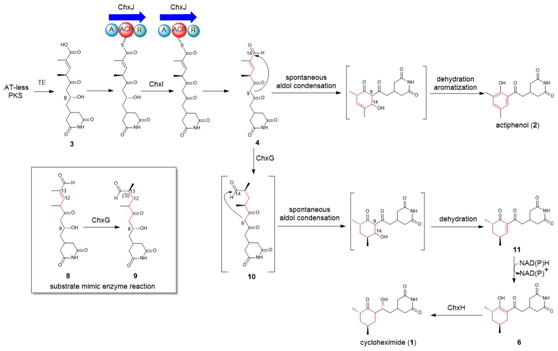
图4:新推导的CHX和APN的生物合成途径。
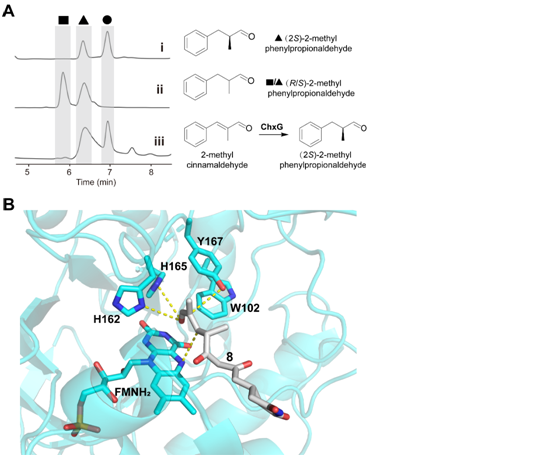
图5:(A) 手性HPLC图谱。 (B)化合物8与ChxG活性口袋对接。
至此,CHX和APN的生物合成途径的细节,包括六元碳环系统的生物合成的新机制得到了完整解析。本研究表明,CHX和APN并非如先前推测的那样由APN催化氢化产生CHX,而是自trans-AT PKS合成了碳骨架后,通过两个平行的途径分别产生的。两种氧化还原酶(ChxJ和ChxI)可以单独产生一种活性中间体,该中间体经历一系列非酶转化以产生APN,而还原酶(ChxG)则作为看门人,将同一中间体引导到产生CHX的合成途径。该研究对作者团队于2014年提出的假设(Yin et al. Org Lett, 2014)进行了进一步修正,扩展了对天然产物生物合成中氧化还原酶介导的酚和环己酮基团形成的理解,并为未来的组合生物合成研究奠定了基础。
suncitygroup太阳新城尹敏副研究员和中国科学院昆明植物研究所黄胜雄研究员、颜一军研究员为文章共同通讯作者。上述工作得到了国家自然科学基金(82225043、 32271523 、82160674),中国科学院战略生物资源计划(KFJ BRP-009-005)和云南省自然科学基金(202201AS070007)等项目的支持。
原文链接:https://pubs.acs.org/doi/10.1021/acscatal.4c03332